FastKing gDNA Dispelling RT SuperMix
Kenmerke
■ vinnig: een stap om genoomverwydering en doeltreffende omgekeerde transkripsie binne 18 minute te voltooi deur slegs sjablone by te voeg.
■ Hoë doeltreffendheid: Die omgekeerde transkriptase word gemodifiseer met 'n hidrofobiese motief, met 'n RT -doeltreffendheid van meer as 95%.
■ Eenvoudig en maklik: Die eksklusiewe termosensitiewe DNase het 'n vinnige effek, hoë doeltreffendheid met korter reaksietyd en beïnvloed nie cDNA nie.
Spesifikasie
Tipe: Gene gemodifiseerde omgekeerde transkriptase, gDNase
Prosedures: Een stap (genomiese DNA-verwydering en RT)
RT -doeltreffendheid: > 95%
Sjabloon: 1 ng- 2 μg
Bedryfstyd: ~ 18 min
Aansoeke: Die omgekeerde getranskribeerde cDNA kan gebruik word in konvensionele PCR, Real -time PCR, cDNA biblioteek konstruksie, SAGE (Serial Analysis of Gene Expression), primer extension en ander konvensionele eksperimente.
Al die produkte kan aangepas word vir ODM/OEM. Vir besonderhede,klik asseblief op Aangepaste diens (ODM/OEM)
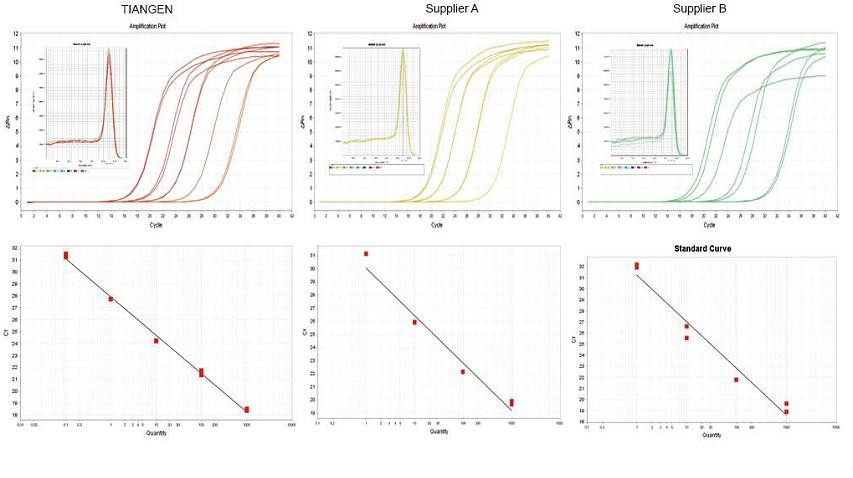 |
Eksperimentele voorbeeld 1. cDNA is gesintetiseer met behulp van een-stap omgekeerde kwantitatiewe reagense van TIANGEN FastKing gDNA Dispelling RT SuperMix, relevante produkte van onderskeidelik verskaffer A en verskaffer B. Ontdek die RN5 -geen van muise met behulp van TIANGEN Talent qPCR PreMix (SYBR Green), en die versterkingskromme, smeltkurwe en standaardkromme is ontleed. Die resultate toon aan dat TIANGEN FastKing gDNA Dispelling RT SuperMix die hoogste kwantitatiewe Ct -waarde het na omgekeerde transkripsie en uitstekende stresweerstand, en dat dit duidelike voordele inhou vir sjablone met hoë onreinheidsreste. |
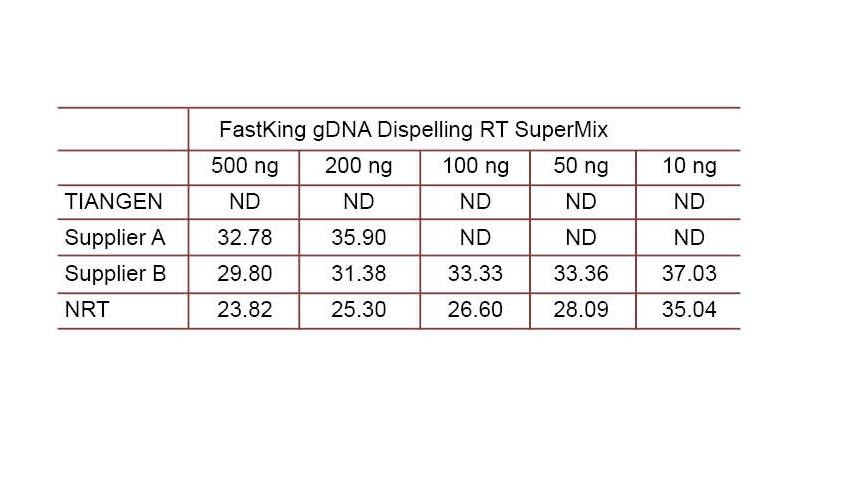 |
Eksperimentele voorbeeld 2. cDNA is gesintetiseer met behulp van een-stap omgekeerde kwantitatiewe reagense van TIANGEN FastKing gDNA Dispelling RT SuperMix, relevante produkte van onderskeidelik verskaffer A en verskaffer B. Ontdek menslike HsG -geen met behulp van TIANGEN Talent qPCR PreMix (SYBR Green) en voeg handmatig verskillende konsentrasies genomiese DNA by om die vermoë van gDNA -verwydering van verskillende reagense op te spoor. Ct -resultate toon dat TIANGEN FastKing gDNA Dispelling RT SuperMix uitstekende vermoë het om genomiese DNA te verwyder. Tot 500 ng genomiese DNA -residu kan perfek verwyder word sonder om die resultate te beïnvloed. ND: Nie opgespoor nie. NRT: Opsporing van die mengsel sonder omgekeerde transkripsie. |
A-1 RNA word afgebreek
—— Reinig hoë kwaliteit RNA sonder besmetting. Die materiaal waaruit RNA onttrek word, moet so vars as moontlik wees om RNA -agteruitgang te voorkom. Ontleed RNA -integriteit op gedenatureerde gel voor RT -reaksie. Na RNA -ekstraksie moet dit in 100% formamide gestoor word. As RNase -remmer gebruik word, moet die verwarmingstemperatuur <45 ° C wees en die pH moet minder as 8,0 wees, anders sal die remmer alle gebonde RNase vrystel. Boonop moet RNase -remmer bygevoeg word in oplossings wat ≥ 0,8 mM DTT bevat.
A-2 RNA bevat remmers van omgekeerde transkripsiereaksies
—— Omgekeerde transkripsieremmers sluit in SDS, EDTA, gliserol, natriumpyrofosfaat, spermidien, formamide, guanidiensout, ens. Meng die kontrole -RNA met die monster en vergelyk die opbrengs met die kontrole -RNA -reaksie om te kyk of daar 'n remmer is. Was RNA -neerslag met 70% (v/v) etanol om remmers te verwyder.
A-3 Onvoldoende uitgloeiing van primers wat gebruik word vir die sintetisering van die eerste string cDNA
- Bepaal dat die uitgloeitemperatuur geskik is vir die primers wat in die eksperiment gebruik word. Vir ewekansige heksamers word dit aanbeveel om die temperatuur vir 10 minute op 25 ° C te hou voordat die reaksietemperatuur bereik word. Vir gene-spesifieke primers (GSP), probeer ander GSP, of skakel oor na oligo (dT) of random hexamer.
A-4 Klein hoeveelheid begin-RNA
—— Verhoog die hoeveelheid RNA. Vir RNA -monsters kleiner as 50 ng, kan 0,1 μg tot 0,5 μg asetiel BSA gebruik word in die eerste string cDNA -sintese
A-5 Die doelvolgorde word nie in die geanaliseerde weefsels uitgedruk nie.
- Probeer ander weefsels.
A-6 PCR-reaksie misluk
—— Vir tweestap RT-PCR kan die cDNA-sjabloon in die PCR-stap nie 1/5 van die reaksievolume oorskry nie.
A-1 Nie-spesifieke uitgloeiing van primers en sjablone
—— Die 3'-einde van primers moet nie 2-3 dG of dC bevat nie. Gebruik Gene-spesifieke primers in die eerste string sintese in plaas van random primers of oligo (dT). Gebruik 'n hoër gloeitemperatuur in die eerste paar siklusse, en dan 'n laer uitgloeiingstemperatuur. Gebruik 'n warm Taq DNA-polimerase vir PCR om die spesifisiteit van die reaksie te verbeter.
A-2 Swak ontwerp van gene-spesifieke primers
—— Volg dieselfde beginsels vir die versterking van primerontwerp.
A-3 RNA besmet met genomiese DNA
Behandel RNA met PCR-graad DNase I. Stel 'n kontrolereaksie op sonder omkering van transkripsie om DNA-besmetting op te spoor.
A-4 Vorming van primer dimeer
—— Ontwerp primers sonder komplementêre rye aan die 3' -einde.
A-5 Te hoog Mg2+ konsentrasie
—— Optimaliseer Mg2+ konsentrasie vir elke sjabloon en primer kombinasie
A-6 Besmet met vreemde DNA
—— Gebruik aerosolbestande punte en UDG-ensieme.
A-1 Die inhoud van die eerste streng produk is te hoog
—— Verminder die hoeveelheid van die eerste streng produk in die konvensionele PCR reaksiestap.
A-2 Te hoë primerhoeveelheid in PCR-reaksie
—— Verminder primer -invoer.
A-3 Te veel siklusse
—— Optimaliseer PCR -reaksietoestande en verminder die PCR -siklusgetal.
A-4 Te lae uitgloeiingstemperatuur
-Verhoog die uitgloeitemperatuur om nie-spesifieke aanvang en uitbreiding te voorkom.
A-5 Nie-spesifieke versterking van oligonukleotiedfragmente wat gegenereer word deur DNase-afbraak van DNA —- Onttrek RNA van hoë gehalte om DNA-besmetting te voorkom.
RT-PCR is om transkripsie van RNA na cDNA om te keer, en gebruik dan die omgekeerde getranskribeerde cDNA as 'n sjabloon vir PCR-reaksie om die teikenfragment te versterk. Kies óf ewekansige primers, Oligo dT en geen spesifieke primers volgens die spesifieke toestande van die eksperiment. Al die bogenoemde primers kan gebruik word vir kort eukariotiese sel -mRNA sonder haarnaaldstruktuur.
Willekeurige onderlaag: geskik vir lang RNA met haarnaaldstruktuur, sowel as alle soorte RNA soos rRNA, mRNA, tRNA, ens. Dit word hoofsaaklik gebruik vir RT-PCR-reaksie van 'n enkele sjabloon.
Oligo dT: Geskik vir RNA met PolyA -stert (prokariotiese RNA, eukariotiese Oligo dT rRNA en tRNA het nie PolyA -sterte nie). Omdat Oligo dT aan PolyA-stert gebind is, moet die kwaliteit van RNA-monsters hoog wees, en selfs 'n klein degradasie sal die hoeveelheid volledige cDNA-sintese aansienlik verminder.
Gene-spesifieke primer: Aanvullend tot die sjabloonvolgorde, geskik vir situasies waar die doelwitreeks bekend is.
Daar is twee maniere:
1. Interne verwysingsmetode: in teorie is cDNA DNA -fragmente van verskillende lengtes, so die gevolg van elektroforese is vlekke. As die RNA -oorvloed laag is, sal geen produk in elektroforese verskyn nie, maar dit beteken nie dat geen produk deur PCR versterk sal word nie. Oor die algemeen kan interne verwysing gebruik word om cDNA op te spoor. As die interne verwysing resultate lewer, kan die kwaliteit van cDNA basies gewaarborg word (in enkele gevalle, as die teikengeenfragment te lank is, kan daar uitsonderings wees).
2. As daar 'n bekende geen is wat deur hierdie sjabloon versterk word, kan dit deur die primers van hierdie geen geverifieer word. Die versterking van interne verwysing beteken nie noodwendig dat daar geen probleem met cDNA is nie. Omdat interne verwysing baie cDNA bevat, is dit maklik om te versterk. As cDNA om verskillende redes gedeeltelik afgebreek word, vanuit die perspektief van waarskynlikheid, sal PCR -resultate van teikengene met 'n lae oorvloed aansienlik beïnvloed word. Alhoewel die interne verwysing nog steeds groot is, word die versterking waarskynlik nie beïnvloed nie.
RNA gedeeltelik afbreek. Ontdek die integriteit en suiwer van RNA
Die RNA -inhoud van verskillende spesies kan anders wees, maar oor die algemeen moet die onttrekte totale RNA twee duidelike 28S- en 18S -bande in gelelektroforese bevat, en die helderheid van die voormalige band moet twee keer so hoog wees as dié van laasgenoemde. Die 5S -band dui aan dat RNA verswak is en dat die helderheid daarvan eweredig is aan die graad van agteruitgang. Die suksesvolle versterking van interne verwysing beteken nie dat daar geen probleem met RNA is nie, omdat die interne verwysing in groot hoeveelhede voorkom, kan RNA versterk word solank die agteruitgang nie ernstig is nie. Die OD260/OD280verhouding van suiwer RNA gemeet deur spektrofotometer moet tussen 1.9 en 2.1 wees. 'N Klein hoeveelheid proteïenonreinheid in RNA sal die verhouding verminder. Solank die waarde nie te laag is nie, sal RT nie geraak word nie. Die belangrikste vir RT is RNA -integriteit.
Die uitbreiding van die interne verwysingsgeen kan slegs aandui dat RT daarin geslaag het, maar dit hou nie noodwendig verband met die kwaliteit van die cDNA -string nie. Omdat die interne verwysingsfragmente oor die algemeen klein en groot is in uitdrukking, is dit makliker om suksesvol te wees in omgekeerde transkripsie. Die grootte en uitdrukking van die teikengeen wissel egter van geen tot geen. Die cDNA -kwaliteit kan nie slegs deur interne verwysing beoordeel word nie, veral vir die doelfragmente langer as 2 kb.
Sommige monsters het komplekse sekondêre strukture, of het 'n ryk GC -inhoud, of is kosbaar met 'n lae hoeveelheid. In hierdie gevalle moet gepaste omgekeerde transkriptase gekies word volgens die grootte van die doelfragment en die monster. Vir RNA -sjablone met 'n hoë GC -inhoud en komplekse sekondêre struktuur, is dit moeilik om die sekondêre struktuur oop te maak by lae temperatuur, of met algemene omgekeerde transkriptase. Vir hierdie sjablone kan Quant Reverse Transcriptase gekies word, aangesien die prestasie van die omgekeerde transkripsie natuurlik beter is as die van M-MLV-reeks reverse transcriptase, wat verskillende RNA-templates doeltreffend kan omskakel en RNA in die maksimum mate in cDNA-eerste string kan transkribeer. By die gebruik van algemene omgekeerde transkriptase -stel kan 'n stelsel van 20 ul slegs effektief 1 μg totale RNA transkribeer. Let op die maksimum RT -kapasiteit van die kit. As die sjabloon in oormaat bygevoeg word, sal omgekeerde transkripsie die RNA met groot oorvloed bevoordeel. Daarom is dit beter om nie die maksimum kapasiteit van die stelsel te oorskry nie.
A-1 Bepaal of RNA ernstig afgebreek word en of RT suksesvol is
Oor die algemeen word die rede vir die mislukking van interne verwysingsversterking dikwels veroorsaak deur ernstige RNA -agteruitgang. 'N Ander moontlike rede is mislukking in omgekeerde transkripsie. Interne verwysing kan nie as 'n standaard gebruik word om die kwaliteit van cDNA -enkeldraad te beoordeel nie, maar dit kan as 'n standaard gebruik word om te bepaal of omgekeerde transkripsie suksesvol is as daar geen probleem is met die RNA -kwaliteit nie. Die belangrikste ding in die omgekeerde transkripsieproses is om 'n konstante temperatuur en 'n konstante reaksiestelsel te handhaaf om die reaksiedoeltreffendheid te verbeter.
A-2 Bepaal of die primers vir die versterking van interne verwysingsgene betroubaar is en of daar probleme is met reagense wat in PCR gebruik word.
Vir relatiewe kwantifisering moet RNA gekwantifiseer word voor omgekeerde transkripsie, wat ook in baie omgekeerde transkripsiestelle vereis word, byvoorbeeld, die RNA -invoer as 1 μg kwantifiseer. Aangesien die omgekeerde getranskribeerde cDNA 'n gemengde oplossing is, insluitend RNA, oligo dT, ensiem, dNTP en selfs 'n bietjie DNA -residu, sal afwyking veroorsaak word, dus is dit onmoontlik om die cDNA akkuraat te kwantifiseer. Daarom is RNA -kwantifisering nodig. Aangesien die omgekeerde transkripsie -doeltreffendheid dieselfde is onder verskillende monsters, moet die hoeveelheid cDNA wat verkry is dieselfde wees, en die kwantitatiewe analise kan die vergelyking van die uitdrukkingsvlakke van verskillende gene in dieselfde hoeveelheid totale RNA toon. By die uitvoer van kwantitatiewe PCR met relatiewe fluoressensie is kwantitatiewe cDNA nie nodig na omgekeerde transkripsie nie, omdat die interne verwysingsgeen as verwysing kan optree.
Dit hou hoofsaaklik verband met die gene, en omgekeerde transkripsie van 'n lang fragment is vir die meeste gene nie haalbaar nie. Eerstens is die doeltreffendheid van omgekeerde transkripsie baie laer as die van PCR. Tweedens beperk die GC -ryk gebied en sekondêre struktuur van baie gene beide omgekeerde transkripsie en PCR. Uiteindelik is die getrouheid en versterkingsdoeltreffendheid van PCR terselfdertyd moeilik om te waarborg. In die proses van omgekeerde transkripsie kan niemand 'n lang fragment vir gene met lae kopie kry nie, veral met behulp van oligo dT. Wat 5 'UTR met meer GC betref, is dit nog moeiliker. Daarom is dit steeds 'n redelike metode om transkripsie met ewekansige primers om te keer, die natuurlike splitsingsplekke in die teikenfragment te vind, te versterk deur segmente en dan die beperking van vertering en ligasie uit te voer. Oor die algemeen is dit moeilik om fragmente groter as 2 kb direk te versterk, maar dit is nie altyd onmoontlik om te verkry nie: 1. Eerstens, waarborg die integriteit van RNA/mRNA, en TRIZOL -ekstraksie word verkies. 2. M-MLV RT-PCR-kit kan direk gebruik word. Verleng die gloeityd en verhoog die siklusgetal in die versterkingsproses behoorlik. Alternatiewelik kan geneste PCR toegedien word, of eers een of twee reaksies uitvoer met gepaste verlengde denaturasie en verlengingstyd voor normale PCR -versterking, wat kan help om fragmente uit te brei. Gee aandag aan die getrouheid van die polimerase. 3. Long Taq kan in PCR gebruik word om ideale resultate te verkry. 4. Vir proteïenuitdrukkingstoepassing moet polimerase van hoë gehalte toegedien word.
TIANGEN bied twee soorte omgekeerde transkriptase aan: Quant/King RTase en TIANScript M-MLV. Die belangrikste verskil tussen hulle is die invoerhoeveelheid sjablone. Quant is 'n unieke omgekeerde transkriptase, wat verskil van die algemeen gebruikte M-MLV afkomstig van Moloney murine leukemie virus. Quant is 'n nuwe hoë-doeltreffende omgekeerde transkriptase wat rekombinant uitgedruk word deur Escherichia coli. Quant is geskik vir die versterking van 50 ng-2 μg RNA met hoë transkripsionele aktiwiteit en hoë opbrengs. In vergelyking met gewone MMLV of AMV, is Quant se grootste kenmerk dat dit baie sterk affiniteit het met RNA -sjablone en dat dit komplekse sjablone kan omskakel sonder denaturasie van hoë temperature. Vir sjablone met 'n hoër GC -inhoud, is die omgekeerde doeltreffendheid hoër. Hierdie omgekeerde transkriptase het egter RNase H -aktiwiteit, wat die lengte van cDNA -produk kan beïnvloed (geskik vir sjablone <4,5 kb). Vir konvensionele omgekeerde transkripsie word TIANScript MMLV omgekeerde transkriptase aanbeveel. Hierdie RTase is 'n gemodifiseerde ensiem met 'n baie swak RNase H -aktiwiteit, wat geskik is vir lang (> 5 kb) cDNA -sintese.
Een-stap omgekeerde transkripsie en PCR-versterking word in dieselfde buis voltooi sonder om die buisdeksel tussen cDNA-sintese en versterking oop te maak, wat nuttig is om besmetting te verminder. Aangesien alle verkreë cDNA -monsters vir amplifikasie gebruik word, is die sensitiwiteit hoër, met 'n minimum van 0,01 pg totale RNA. Vir suksesvolle een-stap RTPCR word gene-spesifieke primers oor die algemeen gebruik om cDNA-sintese te begin. Die tweestap-metode, naamlik omgekeerde transkripsie en PCR-versterking, word in twee stappe uitgevoer. Eerstens word omgekeerde transkripsie vanaf 'n RNA -sjabloon uitgevoer om cDNA te verkry, en die verkreë cDNA word onderwerp aan een of meer verskillende PCR -reaksies. Die tweestap-metode kan oligo (dT) of ewekansige primers gebruik om die sintese van die eerste string van cDNA te lei, en kan alle mRNA-inligting van 'n spesifieke monster transkribeer.
Produk kategorieë
WAAROM KIES ONS
Sedert sy stigting, het ons fabriek produkte van wêreldgehalte ontwikkel volgens die beginsel
van kwaliteit eerstens. Ons produkte het 'n uitstekende reputasie in die bedryf gekry en 'n waardevolle vertroue onder nuwe en ou kliënte.